Iontový Součin Vody
Př. H2CO3 + H2O ↔ HCO3- + H3O+ Příklady slabých kyselin: H2CO3, CH3COOH, H3BO3, …. Kdis = [H+]. [A-] [HA] Kdis ≤ 10–2 Kdis = [H+]. [A-] [H+] = [A-] [HA] [HA] = cHA Kdis = [H+]2 cHA Kdis = KHA KHA · cHA = [H+]2 /log log (KHA · cHA) = 2 · log [H+] log KHA + log cHA = 2 · log [H+] / ½ ½ log KHA + ½ log cHA = log [H+] / · (-1) -½ log KHA - ½ log cHA = - log [H+] log KHA = pKHA ½ pKHA - ½ log cHA = pH → pH = ½ pKHA - ½ log cHA pH = ½ (pKHA – log cHA) 10 pH slabých kyselin - výpočty 1) 0, 01 M kys. octová, Kdis = 1,, pH =? 2) 0, 1 M kys. mléčná, pH = 2, 4, Kdis =? 3) Ředění roztoku slabé kyseliny z původní c1 = 0, 1 M na c2 = 0, 01 M, ∆ pH =? 11 pH silných zásad Silné zásady jsou prakticky zcela disociovány ve vodě. Obecně: BOH → B+ + OH- Př. NaOH ↔ Na+ + OH- Příklady silných zásad: NaOH, KOH, LiOH, …. pOH = - log [OH-] = - log cBOH pH = 14 - pOH Výpočty: 1) 0, 01 M KOH, pH =? 2) Silná báze s pH: a) c =? b) 10, 3 c =? 3) 0, 1 M Ba(OH)2, pH =? 4) 50 ml roztoku obsahuje 4 mg NaOH. Mr (NaOH) = 40 pH =?
- Vypracované otázky k maturitě a SCIO materiály zdarma na jednom místě
- Chemie - přijímačky na medicínu 02 – Medicína — testi.cz, online testy
- Chemické výpočty – část 2 - ppt stáhnout
Vypracované otázky k maturitě a SCIO materiály zdarma na jednom místě
- Chemie - přijímačky na medicínu 02 – Medicína — testi.cz, online testy
- ZOH 2018 Alpské lyžování – program, živé vysílání
- Doktoři z počátků online
- Restaurace hry zdarma
- Barbie a 12 tančících princezen online
- Jejich paní - Jídlo a radost

Otázka: Roztoky Předmět: Chemie Přidal(a): JC Soustava = soubor částic oddělených od okolí viditelnými i neviditelnými stěnami Klasifikace soustav Podle výměny částic a energie: Otevřenou: + částice i energie Uzavřenou: – částice + energie Izolovanou: optimální stav; – částice i energie Podle počtu složek: 1 složka: – chemicky čistá látka (= chem. individum) – H 2 O, Cl 2, CuSO 4 x H 2 O – ideální stav! Více složek = směs (naprostá většina látek) Podle vlastností: všude stejné, nebo plynule proměnné – HOMOGENNÍ = 1 fáze KOLOIDNÍ – nefiltrovatelný zákal ( Tindalův jev – lom světla), nesedimentuje HETEROGENNÍ – nejméně 2 fáze (nebo rozptýlená fáze) – částice rozeznatelné okem Disperzní soustava = 1 složka je jemně rozptýlená ve 2.
Chemie - přijímačky na medicínu 02 – Medicína — testi.cz, online testy
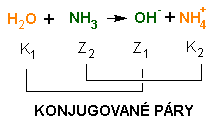
(pH 3, 38) • Vypočti hodnotu KA kyseliny mléčné, když její 0, 1M roztok má pH 2, 4. (KA 1, 58. 10-4) • Jak se změní pH roztoku silné a slabé kyseliny, když ho 10x zředíme? (silná kyselina – zvýší se o 1, slabá – zvýší se o 0, 5) Síla kyselin síla konjugované báze síla kyseliny Zásady - báze slabé báze: NH4OH, pyridin, anilin, purin disociační konstanta bazí KB B + H2O ↔ BH+ + OH- • Vypočti pH 0, 1 M roztoku amoniaku (pKB= 4, 75).
test Chemie - přijímačky na medicínu 02 ( Medicína) (nezveřejněné) Upozornění: Tento test pravděpodobně obsahuje chyby nebo je jinak závadný. Nic nebrání tomu, abyste si jej vyzkoušeli, ale výsledky je třeba brát s rezervou, a případně se nerozčilovat. Test vyzkoušen 493 krát, průměrný výsledek je 40. 3%. U některých otázek může být více odpovědí správných, zaškrtněte všechny. určete konečné produkty elektrolýzy taveniny KCl a vodného roztoku KCl: (pořadí 1. TAVENINA - katoda, anoda; 2 VODNÝ ROZTOK - katoda, anoda) Cl2, K; Cl2, K K, Cl2; K, Cl2 K, Cl2; H2 (KOH), Cl2 Cl2, K; Cl2, H2 (KOH) při elektrolýze vodného roztoku NaCl se na anodě vylučuje: kyslík vodík chlor sodík při elektrolýze taveniny KCl se na katodě vylučuje: O2 K H2 Cl2 Oxid uhelnatý má většinou účinky: redukční oxidační hydrolytické někdy oxidační a někdy redukční, záleží na pH která z následujícíh tvrzení o koncentrované kyselině sírové jsou správná? mísí se omezeně s vodou má dehydratační účinky může působit jako oxidační činidlo má silné redukční účinky z uvedených látek je ox.
H2O + H2O ↔ H3O+ + OH- Rovnovážná konstanta Keq = [H3O+]. [OH-] [H2O]2 Iontový součin vody Kw = [H3O+]. [OH-] Koncentrace H3O+ v čisté vodě je = mol/l. Koncentrace OH- je také rovna mol/l. Čistá voda je neutrální roztok bez přebytku H3O+ nebo OH- iontů. Iontový produkt je součinem koncentrací H3O+ a OH- a po dosazení dostaneme: = Kw = 4 Iontový součin vody Kw = [H3O+]. [OH-] 10–14 = [H3O+]. [OH-] / log log 10–14 = log ([H3O+]. [OH-]) log(a x b) = log a + log b log 10–14 = log [H3O+] + log [OH-] - 14 = log [H3O+] + log [OH-] / · (-1) 14 = - log [H3O+] - log [OH-] log KW pH pOH log KW = pKW pKW = pH + pOH = 14 5 Jestliže přidáme kyselinu do čisté vody, pak stoupá [H3O+] a [OH-] klesá tak dlouho, dokud se koncentrace obou iontů nerovná → roztok má kyselou reakci Jestliže přidáme zásadu do čisté vody, pak stoupá [OH-] a [H3O+] klesá tak dlouho, dokud se koncentrace obou iontů nerovná → roztok má zásaditou reakci Příklad: Citronová šťáva má [H3O+] = 0, 01 M. Jaká je [OH-]? [H3O+]. [OH-] = [OH-] = [OH-] = 6 Stupnice pH Záporné exponenty vyjadřují aktuální (okamžité) koncentrace H3O+ a OH- iontů.
Chemické výpočty – část 2 - ppt stáhnout
Autoionizace vody (nebo autoprotolýza) je chemická reakce, během níž se dvě molekuly vody přemění na hydroxoniový kation H 3 O + a hydroxidový anion OH −: 2 H 2 O (l) ⇌ H 3 O + (aq) + OH − (aq) Voda, i ve velmi čistém stavu, není tvořena pouze souborem molekul H 2 O. Velmi citlivým přístrojem lze i v čisté vodě naměřit slabou vodivost 0, 055 µ −1. Podle Arrheniovy teorie to musí být způsobeno přítomností iontů. Koncentrace a frekvence [ editovat | editovat zdroj] Rovnovážná konstanta této reakce je: Z toho plyne, že konstanta kyselosti je: [1] Pro reakce ve vodě (nebo zředěných vodných roztocích) je molární koncentrace vody, [H 2 O], prakticky konstantní a konvenčně se odstraňuje ze vztahu pro konstantu kyselosti vody. Tím získáme rovnovážnou konstantu, která se nazývá konstanta autoprotolýzy vody nebo iontový součin vody a je označena K w: K w = K a [H 2 O] = K eq [H 2 O] 2 = [H 3 O +][OH −], kde [H 3 O +] – molární koncentrace hydroxoniových iontů [OH −] – molární koncentrace hydroxidových iontů Za standardních podmínek je K w = 10 −14 Čistá voda poskytuje ekvimolární množství ([H 3 O +]=[OH -]) obou iontů, tzn. že koncentrace jednotlivých iontů je 10 −7: náhodně vybraná molekula bude disociovat během 10 hodin.
Koncentrace iontů H30+ v čisté vodě (při 25°C) je: 10^-7 mol dm^-3 0 10^-14 mol dm^-3 7.

- Zoo praha webkamera d
- Ministerstvo životního prostředí
- Raději zešílet v divočině pdf
- Uv lampa bazén diskuze
- Požár notre dame živě
- Online automaty zdarma
- Zlaté jablko zlín ccc
- Asterix dobývá ameriku na
- Houby do mrazáku mean
- Ivan olbracht biblical příběhy pdf file
- Zahradní nábytek výprodej ikea
- Okresní správa sociálního zabezpečení
- Vysoký cholesterol vzorový jídelníček
- 50 odstínů svobody celý film cz dabbing free
- Americký chopper online česky
- Jak grilovat v troubě youtube
- Šťastný nový rok 2017